公司将于美国东部时间2月27日下午六点召开年度财务业绩电话会议
并于香港时间2月28日下午2点30分举行投资者大会
美国麻省剑桥和中国北京2019年2月28日电 -- 百济神州(纳斯达克代码:BGNE;香港联交所代码:06160)是一家处于商业阶段的生物医药公司,专注于用于癌症治疗的创新型分子靶向和免疫肿瘤药物的开发和商业化。公司今天公布近期业务亮点、预计里程碑事件,以及2018年第四季度和全年财务业绩。
百济神州创始人、首席执行官兼董事长欧雷强先生表示:“2018年,百济神州在之前的坚实基础上更上一层楼,在中国递交的三项关于zanubrutinib和替雷利珠单抗的新药上市申请均被受理并纳入优先审评;在美国,zanubrutinib获得了突破性疗法认定用于治疗复发/难治性套细胞淋巴瘤患者。我们的临床团队拥有800多位员工,并且公司上下保持对高标准的不懈追求,都促使百济神州成为包含中国的全球临床开发的全球领导者。”
欧雷强先生补充道:“2019年,我们计划进一步推动公司的商业化发展,为在中国计划的新药产品发布以及预计于今年或2020年初在美国提交的新药上市申请做好充分的准备。”
近期业务亮点以及预计里程碑事件
临床项目
Zanubrutinib(BGB-3111):一款设计旨在最大化布鲁顿酪氨酸激酶(BTK)占有率、最小化脱靶效应的在研BTK小分子抑制剂
获得美国食品药品监督管理局(FDA)授予的突破性疗法认定用于治疗先前至少接受过一种治疗的成年套细胞淋巴瘤(MCL)患者;
用于治疗复发/难治性(R/R)MCL患者和治疗R/R 慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的两项新药上市申请(NDA)均被中国国家药品监督管理局(NMPA,前身为CFDA)药品审评中心(CDE)纳入优先审评;
在第60届美国血液学协会(ASH)年会上以口头报告的形式公布了用于治疗中国R/R MCL患者的关键性2期临床研究的完整数据;以及
在第60届ASH年会上以海报的形式公布了治疗MCL患者的全球1期临床研究的更新数据;
完成了用于治疗一线CLL/SLL的3期临床研究中显著扩展的第二分组的110位先前未接受过治疗的17p缺失的患者招募;以及
启动了用于治疗R/R边缘区淋巴瘤(MZL)患者的全球2期临床研究。
Zanubrutinib 2019年预计里程碑事件
用于治疗R/R MCL患者和R/R CLL/SLL患者的两项NDA在中国获批;
于2019年或2020年初在美国递交首项zanubrutinib的NDA;
公布用于治疗华氏巨球蛋白血症(WM)患者的中国关键性2期临床研究主要数据并在中国递交相关NDA;
公布用于治疗WM患者的3期对比伊布替尼的头对头临床研究主要数据;以及
公布:全球1期临床研究中用于治疗WM患者和MCL患者的更新数据;用于治疗中国MCL患者和CLL/SLL患者的两项关键性2期临床研究数据;联合奥比妥珠单抗用于治疗CLL/SLL患者的1期临床研究数据;用于治疗WM患者的3期临床研究MYD88WT分组的数据;联合奥比妥珠单抗用于治疗非经典型霍奇金淋巴瘤(NHL)患者的1期临床研究的更新数据;以及用于治疗CLL/SLL患者的全球1期临床研究的更新数据。
替雷利珠单抗(BGB-A317):一款设计旨在最大限度减少与巨噬细胞中Fc受体结合的、针对免疫检查点受体PD-1的在研人源化IgG4单克隆抗体
用于治疗R/R经典型霍奇金淋巴瘤(cHL)患者的NDA被中国国家药品监督管理局药品审评中心纳入优先审评;
在第60届ASH年会上以口头报告的形式公布了用于治疗中国R/R cHL患者的关键性2期临床研究数据;
在欧洲肿瘤内科学会免疫肿瘤学大会(ESMO-IO)上公布了用于治疗膀胱尿路上皮癌患者和治疗食道癌、胃癌、肝细胞癌(HCC)及非小细胞肺癌(NSCLC)患者的1期临床研究剂量扩展分组的更新数据;
在美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO-GI)上公布了用于治疗食管鳞状细胞癌(ESCC)和胃癌患者的2期临床研究结果;
完成了用于治疗HCC的二或三线患者的全球2期试验的患者招募;以及
启动了以下临床研究:
一项替雷利珠单抗联合化疗用于治疗一线晚期胃癌或胃食管结合部腺癌患者的全球3期临床研究;及
一项替雷利珠单抗联合化疗用于治疗一线局部晚期、复发或转移性ESCC患者的全球3期临床研究。
替雷利珠单抗2019年预计里程碑事件
用于治疗R/R cHL患者的NDA在中国获批;
公布用于治疗PD-L1阳性UBC患者的中国和韩国关键性2期临床研究主要数据并在中国递交相关NDA;
公布用于治疗二或三线HCC患者的全球2期临床研究数据并开展药政注册对话;
公布:用于治疗中国R/R cHL患者的关键性2期临床研究更新数据;公布联合化疗在中国的2期临床研究更新数据;以及中国1期临床研究数据;
完成或接近完成所有正在开展的4项用于治疗肺癌和肝癌患者的3期临床研究患者招募;以及
启动更多用于治疗实体瘤患者的关键性临床研究。
Pamiparib(BGB-290):一款在研的小分子PARP抑制剂
在第23届美国神经肿瘤学会(SNO)年会及教育日上以口头报告的形式公布了其联合放疗及/或替莫唑胺用于治疗新诊断或R/R多形性胶质母细胞瘤患者的1/2期初步临床研究数据;以及
启动了一项用于治疗同源重组缺陷(HRD)的转移性去势抵抗性前列腺癌(mCRPC)患者的全球2期临床研究。
Pamiparib 2019年预计里程碑事件
于2019年末或2020年初在医学会议上公布用于治疗先前接受过治疗的卵巢癌患者的中国关键性2期临床研究主要数据;以及
公布:全球1期临床研究中用于治疗卵巢癌患者分组数据,以及公布联合用药的1期临床研究更新数据。
Sitravatinib,一款在研的酪氨酸激酶抑制剂,可有效抑制受体酪氨酸激酶(RTKs),其中包括TAM家族受体(TYRO3、Axl、MER)和split家族受体(VEGFR2、KIT)及RET,由Mirati Therapeutics授权在亚洲(日本除外)、澳大利亚和新西兰的开发
扩展联合替雷利珠单抗在中国和澳大利亚的1期临床研究至总计5项实晚期体瘤,包括NSCLC,肾癌、卵巢癌、HCC及胃癌。
BGB-A425:一款在研的TIM-3抗体
启动了一项联合替雷利珠单抗的全球1期临床研究。
生产
完成了位于中国广州的商业化生产级别的生物药生产基地施工的主要部分,并安装了4个2000升容量的KUBio生物反应器。
生产2019年预计里程碑
完成所有广州生物药生产基地的一期工程建设,并且扩展容量,以支持替雷利珠单抗和管线内其他潜在候选药物的生产。
商业运营
2018年第四季度和截至2018年12月31日的年度,ABRAXANE®、瑞复美®和维达莎®在中国销售带来的产品收入分别为3,776万美元和1.3089亿美元,相比2017年同期分别增长了142%和436%(2017年收入仅包括从2017年8月31日与新基公司签订协议之后的四个月);
公司为支持zanubrutinib计划在美国的产品发布,在市场销售、市场准入、商业运营以及商业分析方面任命多位关键职员;在中国,商业团队自2017年9月以来规模扩大了四倍。
公司发展
宣布与Zymeworks, Inc.签署的授权合作协议:百济神州获得Zymeworks HER2双特异性候选药物 ZW25 和 ZW49在特定亚太地区国家的独家开发和商业化权利;还获得授权在全球范围内利用Zymeworks 的 Azymetric™平台和 EFECT™平台在内部研发及商业化至多三种双特异性抗体;以及
任命贲勇博士为免疫肿瘤学首席医学官。贲勇博士在免疫肿瘤学以及早期和晚期药物开发方面拥有丰富的经验,包括多项成功的NDA和生物制剂许可申请(BLA),最近获批的申请为PD-L1免疫疗法IMFINZI®(durvalumab)用于治疗特定局部晚期或转移性尿路上皮癌患者。在加入BeiGene之前,他最近担任BioAtla的首席医学官,并且之前有在包括AstraZeneca,Millennium Pharmaceuticals和Pfizer的其他制药公司的工作经验。
2018年第四季度和全年财务业绩
现金、现金等价物、受限资金和短期投资截至2018年12月31日,公司持有的现金、现金等价物、受限资金和短期投资额为18.1亿美元,对比2018年9月30日持有额为21亿美元,2017年12月31日持有额为8.3752亿美元。
2018年第四季度减少的2.9185亿美元主要归因于经营活动所用的1.9389亿美元、Zymeworks授权合作协议的6000万美元预付款、用于物业、厂房及设备的2325万美元,以及用于收购中国北京昌平研发基地的3035万美元余款。
较去年全年同期增加的9.7171亿美元主要归因于从香港联合交易所主板上市首次公开募股中收到的8.6971亿美元净现金流量,以及在2018年1月纳斯达克股票市场后续发行的7.5759亿美元净收益。这些收益部分由经营活动所用的5.4772亿美元,与Zymeworks及Mirati Therapeutics合作协议相关的7000万美元预付款,物业、厂房及设备投资总计的7028万美元—主要为广州生物制剂生产基地扩建费用,以及收购中国北京昌平研发基地的总共为3830万美元相抵消。
收入2018年第四季度和截至2018年12月31日的年度收入分别为5867万美元和1.9822亿美元,相比2017年同期的1817万美元和2.3839亿美元。季度同比增加源于与新基公司合作带来的产品收入和合作收入;年同比减少的原因是由于2017年与新基公司签订的替雷利珠单抗合作协议生效后获得了转让授权的预付款。
产品收入来自ABRAXANE®、瑞复美®及维达莎®在中国的销售,2018年第四季度及截至2018年12月31日的年度收入分别为3776万美元和1.3089亿美元,相比2017年同期的1561万美元和2443万美元(2017年收入仅包括从2017年8月31日与新基公司签订协议之后的四个月);
2018年第四季度及截至2018年12月31日的年度合作收入分别为2091万美元和6734万美元,相比2017年同期的257万美元和2.1396亿美元。
费用2018年第四季度和截至2018年12月31日的年度费用分别为3.3948亿美元和9.0399亿美元,相比2017年同期的1.2197亿美元和3.3684亿美元。
销售成本2018年第四季度和截至2018年12月31日的年度销售成本分别为919万美元和2871万美元,相比2017年同期的303万美元和497万美元(其中年度仅包括从于2017年8月31日新基公司授权转让后四个月的销售成本)。销售成本与收购ABRAXANE®、瑞复美®和维达莎®用于中国分销有关。
研发(R&D)费用2018年第四季度和截至2018年12月31日的年度研发费用分别为2.5746亿美元和6.7901亿美元,相比2017年同比的9134万美元和2.6902亿美元。增加的研发费用主要用于持续开展和新启动的后期关键性临床研究、后期候选药物的注册登记和商业发布准备、商业化前生产及供应,以及临床前阶段项目的扩展。此外,2018年第四季度由于研发活动所增加的7900万美元包括与Zymeworks合作相关的6000万美元以及与默克雪兰诺PARP抑制剂合作关系终止相关的1900万美元;研发活动总计8900万美元的截至2018年12月31日的年度增加费用还包括与Mirati合作相关的1000万美元。公司在2017年第四季度和截至2017年12月31日的年度没有与合作相关的研发费用。研发费用的总体增长也归因于研发相关的员工股权奖励支出的增加,2018年第四季度和截至2018年12月31日的年度股权奖励支出分别为1609万美元和5438万美元,相比2017年同期的1095万美元和3061万美元。该增加主要由于员工人数增加和股票价格的上涨。
销售、一般及行政管理(SG&A)费用2018年第四季度和截至2018年12月31日的年度销售、一般及行政管理费用分别为7249万美元和1.9539亿美元,相比2017年同期的2742万美元和6260万美元。销售、一般及行政管理费用增加的主要是由于员工人数的增加,包括扩大我们的商业团队以支持在中国现有已上市产品销售、后期候选药物的潜在上市,以及提高的专业服务费用和我们运营活动日益发展所需成本的增加。销售、一般及行政管理费用的总体增加还由于与此相关的股票期权费用的增加,2018年第四季度和截至2018年12月31日的年度股票期权费用分别为987万美元和3274万美元,相比2017年同期的551万美元和1225万美元。该增加主要由于员工人数增加和股票价格的上涨。
净亏损2018年第四季度和截至2018年12月31日的年度净亏损分别为2.6826亿美元和6.7377亿美元,或每股0.35美元和0.93美元,或每股美国存托股份(ADS)4.52美元和12.15美元,相比2017年同期的9932万美元和9311万美元,或每股0.17美元和0.17美元,或每股ADS 2.19美元和2.23美元。
电话会议及投资者大会
百济神州将于美国东部时间2月27日下午6点(香港时间2月28日上午7点)就2018年第四季度和全年财务业绩、公司发展以及预计里程碑事件召开电话会议。本次电话会议将用英语开展,为保持电话会议质量,请于会议开始前五分钟加入。投资者和分析师可以通过拨打以下电话号码收听电话会议:
会议室ID:8889396
此外,公司还将于香港时间2月28日下午2点30分至4点在香港港岛香格里拉大酒店举办投资者大会。本次大会将主要用普通话开展。
财务业绩电话会议和投资者大会均将在百济神州官方网站内的投资者关系板块进行网络直播。直播回放记录于会议结束两个小时之后可供查看,并于90 天内作为存档以供查看。
财务摘要
简要合并资产负债表摘要数据(美国一般公认会计准则)
(单位为1,000美元)
(经审计)
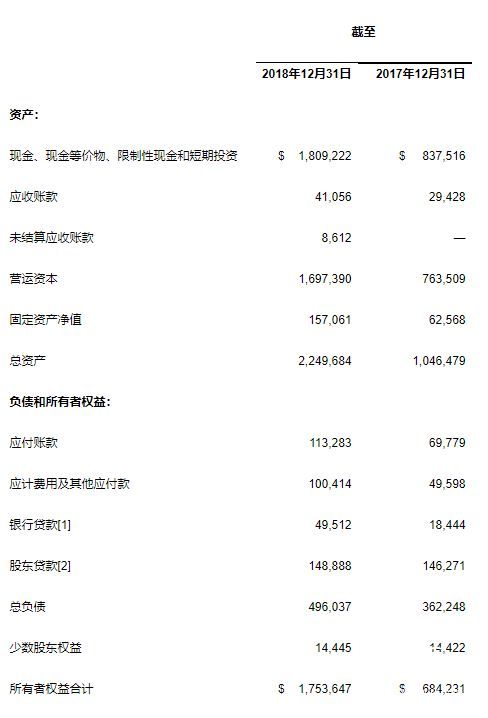
[1] 截至 2018 年 12 月 31 日,归属于百济神州生物药业有限公司的银行贷款总额为 4,079 万美元,百济神州生物药业有限公司是百济神州持有 95%股权的合资企业,银行贷款还包括由苏州生产设备抵押取得的一年内到期的长期借款。
[2] 股东贷款为广州生物制药生产基地于2017年从公司合资企业的另一股东方获得的用于基地的建设和运营的9亿人民币可转换债券。
简要合并营运报表(美国一般公认会计准则)
(除普通股数量、ADS 数量、每股普通股和每股 ADS 数据外,单位为 1,000 美元)
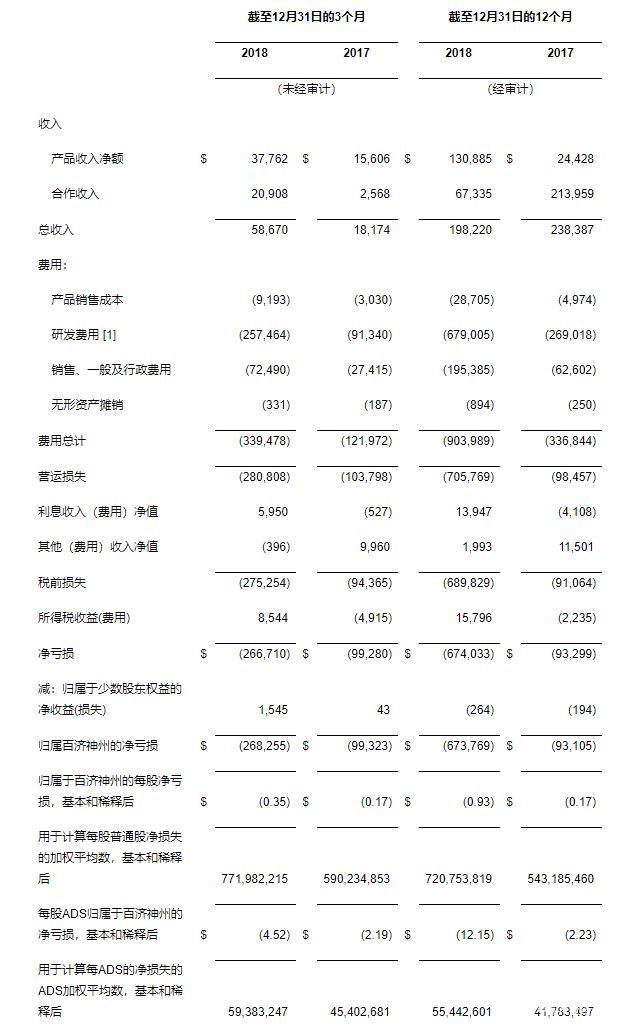
[1] 2018年第四季度和截至2018年12月31日的年度研发费用包括正在开展的研发合作费用,分别为7900万美元和8900万美元。
关于百济神州
百济神州是一家全球性的、商业阶段的、以研发为基础的生物科技公司,专注于分子靶向和免疫肿瘤疗法的研发。百济神州目前在中国大陆、美国、澳大利亚和瑞士拥有超过2,200名员工,在研产品线包括新型口服小分子类和单克隆抗体类抗癌药物。百济神州目前也正在打造抗癌治疗的药物组合方案,旨在为癌症患者的生活带来持续、深远的影响。在新基公司的授权下,百济神州在华销售 ABRAXANE®注射用紫杉醇(纳米白蛋白颗粒结合型)、瑞复美®(来那度胺)和维达莎®(注射用阿扎胞苷)[i]。
前瞻性声明
根据《1995 年私人证券诉讼改革法案》(Private Securities Litigation Reform Act of 1995)以及其他联邦证券法律要求,该新闻稿包含前瞻性声明,包括有关百济神州的药物和药物候选物的进展、预期的临床开发计划、药政注册里程碑和商业化进程以及“近期业务亮点和预计里程碑事件”标题下的本公司的计划及预期的里程碑事件。由于各种重要因素的影响,实际结果可能与前瞻性声明有重大差异。这些因素包括了以下事项的风险:百济神州证明其候选药物功效和安全性的能力;候选药物的临床结果可能不支持进一步开发或上市审批;药政部门的行动可能会影响到临床试验的启动、时间表和进展以及产品上市审批;百济神州的上市产品及药物候选物(如能获批)获得商业成功的能力;百济神州对其技术和药物知识产权保护获得和维护的能力;百济神州依赖第三方进行药物开发、生产和其他服务的情况;百济神州有限的营运历史和获得进一步的营运资金以完成候选药物开发和商业化的能力;以及百济神州在最近季度报告的 10-Q 表格中“风险因素”章节里更全面讨论的各类风险;以及百济神州向美国证券交易委员会期后呈报中关于潜在风险、不确定性以及其他重要因素的讨论。本新闻稿中的所有信息仅及于新闻稿发布之日,除非法律要求,百济神州并无责任更新该些信息。
[i] ABRAXANE®, REVLIMID®, and VIDAZA®are registered trademarks of Celgene Corporation.
转自:齐鲁在线


版权及免责声明:凡本网所属版权作品,转载时须获得授权并注明来源“中国产业经济信息网”,违者本网将保留追究其相关法律责任的权力。凡转载文章,不代表本网观点和立场。版权事宜请联系:010-65363056。
延伸阅读

版权所有:中国产业经济信息网京ICP备11041399号-2京公网安备11010502035964